
脑性瘫痪的早期诊断
“我的宝宝会走路吗?”是新生儿重症监护病房(neonatal intensive care unit,NICU)和NICU随访诊所中家长询问小儿神经科医生最常见的问题之一。在NICU的背景环境下,这个问题的背后指的是孩子罹患脑性瘫痪(cerebral palsy,CP)的风险。根据现有的研究数据,CP的早期发现与那些具有发育障碍高风险的婴儿具有临床相关性。关于如何准确定义高危人群尚未达成共识,但有国际公认的建议。已知极早产儿(妊娠32周以下出生)和具有1个或多个重要危险因素的婴儿(例如出生/新生儿期有异常的神经表现或症状,和/或具有异常的神经影像学表现)获得不良预后的风险最高(https://newborn-health-standards.org/).
人们经常质疑是否可以在早期即可诊断CP,如果可以,是否有任何证据表明这是值得的。新进的研究数据支持早期干预,主要基于其对先天性大脑可塑性的影响,而先天性大脑的可塑性在生命早期处于最活跃的阶段。从一项动物实验研究中得出一个重要结论,如果不积极使用大脑的运动皮层,则失去皮层神经联系和相应功能的风险很高[1]。此外,与积极的早期干预相比,因延迟诊断而拖延了干预的效果更差。
CP高风险的早期发现依赖于患者详细的病史、发育评估、结构化和有效的神经学检查或神经运动评估、脑成像和适用于鉴别诊断的进一步的病因学检查(例如神经生理学或遗传学检查)。本综述着重于CP并讨论与其相关的危险因素、临床分类以及旨在早期诊断CP的可行性检查的循证医学证据。此外,还讨论了脑成像在早期诊断中的作用。
1 CP
1.1 定义
CP被定义为一组与运动和姿势发育相关的疾病,是由于在发育中的胎儿或婴儿大脑发生的非进行性的损伤所致,会导致活动受限[2]。CP可能仅表现为运动问题,但诸如感觉障碍、听觉和视觉障碍、沟通和学习问题、智力障碍、癫痫、行为和肌肉骨骼问题等并发症很常见[2-4]。
1.2 流行病学
CP的患病率因国家而异[5],在高收入国家大约为2‰[6],以男性为主[7]。尽管CP的起源是多因素的,但随着出生时胎龄的降低,发生CP的风险增加。然而,在过去十年的报告[8-10]表明早产儿的CP患病率正在下降。Sellier等[10]的一项数据库研究中(包括20个欧洲人口登记册)显示:1980年至1996年期间,极低出生体重(1 000~1 499 g)婴儿的CP患病率从70.9‰下降到35.9‰。尽管早产儿罹患CP 的风险会增加,但足月儿中罹患CP的绝对数量更高(54.5%)[11]。由于早产儿的病死率较高,低收入国家的足月婴儿的CP患病率较高。
1.3 危险因素
对于CP的危险因素,其最重要的临床建议是将避免诱发CP的危险因素和病因的理念贯穿于每个治疗个体中。迄今为止,若干种危险因素已被报道,其中一些是部分重叠和相互作用的[12],系统地筛选所有与妊娠期相关的危险因素,即产前、围产期和产后因素的信息对于临床工作很有帮助。产前因素包括家族性遗传的凝血问题、胎儿宫内窘迫、宫内发育迟缓、多胞胎、早产、母婴感染和胎盘损伤等。在围产期因素中,单纯性的出生窒息所造成的影响已被证明远没有既往认为的那么重要[13]。围产期内出现的核黄疸、生后使用类固醇、出现败血症和脑膜炎,这些都可能参与了CP的发生、发展这一复杂过程[12]。脑积水和头部外伤是可能的产后危险因素。与CP相关的最常见影像学表现将在本综述的后面部分讨论。如果在患者病史或临床症状进展过程中没有可识别的危险因素,或者如果脑部影像学资料不支持CP的诊断,建议对CP的鉴别诊断进行彻底调查。
1.4 分类
描述CP最常用的方法是基于临床特征,即CP累及的身体部位的表现。四肢瘫痪时,四肢均受累;双瘫时,双下肢功能受限;在偏瘫中,只有一侧身体表现出典型的脑瘫表现。欧洲脑瘫监测组织(Surveillance of Cerebral Palsy in Europe, SCPE)提供了另一种分类CP的方法,它将CP分为单侧(身体一侧)或双侧(身体两侧)类型。根据澳大利亚脑瘫报告[14],所有CP儿童中有38%为单侧受累的CP,而在双侧受累的CP患者中,37%为双瘫,24%为四肢瘫痪。SCPE专家组[15]就如何将CP亚型定义为四大类提供了建议:痉挛型CP(包括单侧和双侧类型)、运动障碍型CP(包括肌张力障碍和舞蹈手足徐动型)、共济失调型CP和不可分类的CP。痉挛型是最常见的(占86%),而运动障碍型、共济失调型和不可分类型分别占病例的6%、5%和3%。通常可以在所有2岁以上的患者中确定CP亚型。
2 CP早期的临床特征
在新生儿期和婴儿期早期,运动功能异常如运动发育迟缓的这种临床症状对于CP而言通常没有特异性。相反,它们却是在中枢神经系统的不同损伤和紊乱中常见的症状。事实上,由于中枢神经系统在婴儿早期(即2岁之前)发育迅速,因此神经系统症状的发现总是在变化——在这一时期内是否能诊断出CP一直存在争议。此外,早期非特异性的神经系统症状如何转变为CP特异性体征的临床模式在婴儿中差异很大。与CP相关的各种脑损伤表现的特征也各不相同,个体因素(例如神经可塑性、一般健康状况)和环境因素(例如,家庭相关因素、干预)也会进一步影响临床表现。表1列出了CP常见的早期症状和体征。
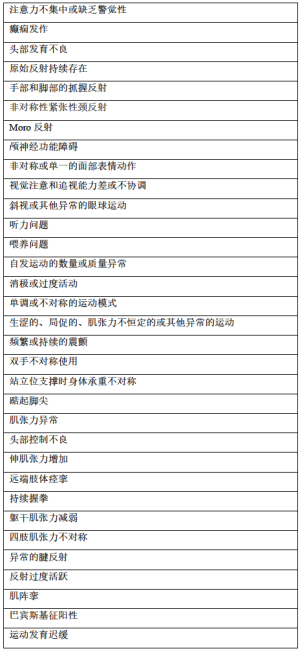
Full table
根据Hubermann等[16]的研究,曾经入住NICU的儿童被诊断为CP的时间(平均9.3±10.2个月)比那些后来发展成为CP但未曾入住NICU的患儿要早得多(平均28.1±24.9个月)。此外,来自初级保健提供者给出的确诊时间有较长的延迟(平均28.8±27.1个月),这表明其缺乏对CP早期症状的认识,建议需要为初级阶段的保健提供者加强教育。
3 基于循证医学证据的评估工具
Novak等[17]的系统性回顾分析表明:在纠正月龄5月龄前,3种最佳检测CP高风险的工具为1)新生儿磁共振成像(MRI,敏感度86%~89%)[18];2)全身运动质量评估(Prechtl Qualitative Assessment of General Movements,GMs;敏感度98%)[19];3)Hammersmith婴幼儿神经系统检查(Hammersmith Infant Neurological Examination,HINE;敏感度90%)[20]。在纠正月龄达5月龄后,最佳的风险预测方法是脑部MRI(敏感度86%~89%)、HINE(敏感度90%)和婴幼儿神经发育评估(Developmental Assessment of Young Children,DAYC;敏感度83%)[21]。CP高风险的定义是基于明显的运动功能障碍和已知与CP相关的异常脑成像结果和(或)表明CP风险的临床病史的综合结论。
3.1 全身运动质量评估
GMs是足月后前3个月内最常见的运动模式,GMs的一个特点是身体的所有部位都参与这些自发运动。自足月后11~16周,GMs表现为所谓的不安运动,被描述为全身性、不规则、连续不断、小而流畅的运动。不安运动的出现代表了运动功能重组的一个阶段,引发目标导向的运动活动[22]。研究[17]表明:缺乏或异常的不安运动的出现可以预测CP,准确率为95%~98%。据报道,在一组极早产儿中,将GMs与脑部MRI的结果相结合在预测CP上可有高达100%的敏感性和特异性[23]。在诊所里,当婴儿完全清醒,没有哭泣或惊恐,穿着轻便的连体衣仰卧时,很容易进行GMs的视频录制。2~5 min的高质量的视频记录足以可靠地评估不安运动的模式。在医院环境之外,关于GMs在一般新生儿人群中的预测价值的研究数据仍然很少,这阻碍了其在低风险人群中检测高危婴儿的潜在应用[24-25]。
3.2 Hammersmith婴幼儿神经系统检查
HINE评估是一种简单、可量化的神经学检查方法,适用于2~24月龄的婴儿[26]。这种神经学检查的目的是发现异常的神经学体征。HINE已被证实具有很强的神经解剖学相关性(即良好的结构效度)。HINE这种评估方法由3个部分组成:神经系统检查、发育里程碑和行为。神经学部分共有26个项目,涵盖颅神经功能评估、姿势、动作、肌张力、反射和反应。发育里程碑部分旨在记录婴儿在进行神经系统检查期间的运动发育情况。发育里程碑包括头部控制、坐姿、主动抓握、踢腿、翻身、爬行、站立和行走。行为部分也是检查的重要组成部分,因为神经学检查结果的可靠性与幼儿的情绪状态和社交取向有关。CP典型的不同临床表现的模式是HINE应用的关键因素(例如1只手握拳会使其上肢的肌张力增高,同时会影响身体同侧躯干的肌张力,使其减弱)。
HINE的神经系统部分(第1章节)是可以进行量化评分的(整体评分范围为0~78分)。在3、6、9和12月龄时也可获得相关的常模参考分数范围,分别来自足月婴儿(胎龄37周或以上)、中度早产儿(胎龄33~36周)和极早产儿(胎龄32周及以下)[26-27]。现已证实在3月龄时使用HINE对CP进行预测,其敏感度可达96%,而特异性则达87%[28]。在矫正年龄超过5月龄时使用HINE对CP进行预测的精准度可达90%[20]。此外,GMs和HINE的综合使用可以提高诊断的准确性[29]。因为HINE评估的分数可以预测患有CP的婴儿的后期步行能力[27,30],因此这是一种针对性强且对临床诊疗非常有用的评估方法。HINE的优点是它可以用于婴儿的序贯随访。在临床上,持续存在或增加的异常神经系统症状的表现是诊断CP的基础。
使用HINE评估不需要获取官方认证系统。在网站www.hammersmith-neuro-exam.com上可以获取已翻译成多种语言的评估方法、教学视频和主要的参考资料。作为一种神经系统检查,使用HINE评估检测神经系统异常的检出率大体上与医院设备环境无关。
3.3 标准化运动评估工具
婴幼儿神经发育评估(DAYC)是一种标准化的交互式问卷,其中孩子的发育里程碑由家长提供。
Maitre等[21]使用DAYC评估那些后来被诊断为CP的早产和足月的NICU患儿,发现6月龄和12月龄患儿的得分下降,在无CP的患者中未观察到这种现象。据报道,由DAYC量化得出的运动发育延迟对CP的预测率达89%[17]。另一项标准化评估——Alberta婴儿运动量表(Alberta Infant Motor Scale,AIMS),其异常运动结果对CP的预测率为86%[17]。AIMS是一种通过观察来评估婴儿运动发育的工具,用于识别生后至18个月龄内非典型的运动发育[31]。AIMS的优势在于它在临床工作中能简易且快速执行,根据作者的经验,即使由社区新生儿诊所的物理治疗师进行评分,它也能很好地反映情况。
4 临床神经影像学
CP的诊断基于临床标准。因此,根据定义,如果不能安全地进行脑部成像或由于技术和财政资源的原因不能安排检查,则脑部成像不是诊断的必要条件。有学者通过脑成像了解与CP发展和临床表型相关的可能致病机制,发现脑部MRI优于其他成像方式[17]。由于辐射负荷和分辨率欠佳,不应使用计算机断层扫描(computed tomographyCT)来进行检查。相反,建议将头颅超声(cranial ultrasound,cUS)与脑部MRI结合使用,或者在MRI不可行的情况下作为首选方法来检查[32-33]。
最常见的损伤类型是白质损伤(19%~45%),灰质损伤占21%,而局灶性血管损伤和畸形分别占10%和11%[34]。
使用cUS得出的异常结果对CP的预测有高度特异性和敏感性。例如,在高危早产儿的两组队列(≤32周和33~36周)研究中,使用cUS检测出现III级出血、静脉梗塞、脑室周围白质软化和局灶性梗死的情况对CP预测的特异性分别为95%、99%,敏感性分别为76%、86%[32]。在出生后的前4~6周内序贯进行cUS检查是极为重要的,并且由于临床上出现显著的囊肿的演变时间不同,建议在孕36~40周进行第1次的cUS检查[32]。
据报道,在85%~86%的脑瘫儿童中,脑MRI能检测到异常[34-35]。对于细微的白质病变、内囊后肢(posterior limb of internal capsule,PLIC)的髓鞘形成和小脑病变的检测,使用脑部MRI检查的效果优于cUS[33]。Mercuri等[36-37]的研究表明:PLIC的髓鞘形成是显示运动功能的良好预测指标;同时,在患有大脑中动脉梗塞的足月婴儿中,出现脑实质白质、基底节和丘脑以及PLIC的受累可能会导致偏瘫。
5 CP的鉴别诊断
对于鉴别诊断,应该考虑儿童的全面发育,因为认知障碍常常伴随运动发育迟缓出现。分离性运动发育(即粗大运动发育暂时落后于其他方面的发育)和臀移是早期运动活动中常见的良性变异表现,轻度韧带松弛也是中常见的体征。
建议对病因不明的CP儿童进行脑成像检查[18]。如果没有典型的CP的脑部表现,或者患者病史中有非特异临床表现(例如CP家族史),则应该考虑进行有针对性的基因检测(例如遗传性痉挛性截瘫、脊髓小脑共济失调、微缺失/重复或其他染色体畸变)、代谢检查(如线粒体疾病、生物素酶缺乏症)或神经生理学检查(如臂丛神经麻痹)[38]。
6 结语
关于是否可以在两岁之前早期诊断CP一直存在争议。尽管存在各种疑问,但既往的研究证据表明,在6月龄前就可以预测到罹患CP的风险。从孩子、父母和社会的角度来看,CP的早期识别很重要。新近的研究报告提供的数据表明,利用系统性的家庭指导等方法作为早期干预手段可以对高危婴儿的整体功能预后产生积极影响[39-40]。对于CP早期干预的特效方法仍在研究当中,但包括运动和感觉刺激以及在家庭环境中激活儿童日常生活能力的方法在目前来说被认为是最有效果的[25,41]。
CP的早期检测依赖于基本的临床原则,结合详细的病史,尤其是已知的CP危险因素、发育评估和有效的神经系统检查或神经运动评估。现有的基于循证医学证据的评估工具——GMs和HINE在经过适当的培训后,相对容易融入临床中使用。强烈建议将脑成像检查作为临床诊断过程中的一个必备条件。
致谢
基金:无。
脚注
利益冲突:作者已完成ICMJE统一格式的信息披露表(可在 https://pm.amegroups.com/article/view/10.21037/pm-20-53/coif 查询)。 作者没有需要声明的利益冲突。
道德声明:作者对本文内容的各个方面负责,确保与本文内任何部分的准确性或完整性相关的问题得到恰当的调查和解决。
开放获取声明:这是一篇根据知识共享署名-非商业性使用-禁止衍生4.0国际许可证 (CC BY-NC-ND 4.0) 发布的开放获取文章,该许可证允许文章的非商业复制和分发,但有严格的限制条件:不能进行任何更改或编辑,并正确引用原始作品(包括通过相关DOI和 icense 链接到正式出版物)。
References
- Martin JH, Chakrabarty S, Friel KM. Harnessing activity-dependent plasticity to repair the damaged corticospinal tract in an animal model of cerebral palsy. Dev Med Child Neurol 2011;53:9-13. [Crossref] [PubMed]
- Rosenbaum P, Paneth N, Leviton A, et al. A Report: The Definition and Classification of Cerebral Palsy April 2006. Dev Med Child Neurol Suppl 2007;109:8-14. [PubMed]
- Ricci D, Romeo DM, Gallini F, et al. Early visual assessment in preterm infants with and without brain lesions: correlation with visual and neurodevelopmental outcome at 12 months. Early Hum Dev 2011;87:177-82. [Crossref] [PubMed]
- Novak I. Evidence-based diagnosis, health care, and rehabilitation for children with cerebral palsy. J Child Neurol 2014;29:1141-56. [Crossref] [PubMed]
- Donald KA, Samia P, Kakooza-Mwesige A, et al. Pediatric cerebral palsy in Africa: a systematic review. Semin Pediatr Neurol 2014;21:30-5. [Crossref] [PubMed]
- Himmelmann K, Uvebrant P. The panorama of cerebral palsy in Sweden. XI. Changing patterns in the birth-year period 2003-2006. Acta Paediatr 2014;103:618-24. [Crossref] [PubMed]
- Chounti A, Hägglund G, Wagner P, et al. Sex differences in cerebral palsy incidence and functional ability: a total population study. Acta Paediatr 2013;102:712-7. [Crossref] [PubMed]
- Hack M, Costello DW. Trends in the rates of cerebral palsy associated with neonatal intensive care of preterm children. Clin Obstet Gynecol 2008;51:763-74. [Crossref] [PubMed]
- van Haastert IC, Groenendaal F, Uiterwaal CSJ, et al. Decreasing incidence and severity of cerebral palsy in prematurely born children. J Pediatr 2011;159:86-91.e1. [Crossref] [PubMed]
- Sellier E, Platt MJ, Andersen GL, et al. Decreasing prevalence in cerebral palsy: a multi-site European population-based study, 1980 to 2003. Dev Med Child Neurol 2016;58:85-92. [Crossref] [PubMed]
- Bax M, Tydeman C, Flodmark O. Clinical and MRI correlates of cerebral palsy: the European Cerebral Palsy Study. JAMA 2006;296:1602-8. [Crossref] [PubMed]
- Korzeniewski SJ, Slaughter J, Lenski M, et al. The complex aetiology of cerebral palsy. Nat Rev Neurol 2018;14:528-43. [Crossref] [PubMed]
- Nelson KB, Ellenberg JH. Antecedents of cerebral palsy. Multivariate analysis of risk. N Engl J Med 1986;315:81-6. [Crossref] [PubMed]
- ACPR Group (2013), Australian Cerebral Palsy Register Report, Sydney, Cerebral Palsy Alliance. Available online: https://cpregister.com/wp-content/uploads/2018/05/ACPR-Report_Web_2013.pdf [Accessed 6 April 2019]
- Surveillance of Cerebral Palsy in Europe. Surveillance of cerebral palsy in Europe: a collaboration of cerebral palsy surveys and registers. Surveillance of Cerebral Palsy in Europe (SCPE). Dev Med Child Neurol 2000;42:816-24. [PubMed]
- Hubermann L, Boychuck Z, Shevell M, et al. Age at Referral of Children for Initial Diagnosis of Cerebral Palsy and Rehabilitation: Current Practices. J Child Neurol 2016;31:364-9. [Crossref] [PubMed]
- Novak I, Morgan C, Adde L, et al. Early, Accurate Diagnosis and Early Intervention in Cerebral Palsy: Advances in Diagnosis and Treatment. JAMA Pediatr 2017;171:897-907. [Crossref] [PubMed]
- Ashwal S, Russman BS, Blasco PA, et al. Practice parameter: diagnostic assessment of the child with cerebral palsy: report of the Quality Standards Subcommittee of the American Academy of Neurology and the Practice Committee of the Child Neurology Society. Neurology 2004;62:851-63. [Crossref] [PubMed]
- Bosanquet M, Copeland L, Ware R, et al. A systematic review of tests to predict cerebral palsy in young children. Dev Med Child Neurol 2013;55:418-26. [Crossref] [PubMed]
- Romeo DM, Ricci D, Brogna C, et al. Use of the Hammersmith Infant Neurological Examination in infants with cerebral palsy: a critical review of the literature. Dev Med Child Neurol 2016;58:240-5. [Crossref] [PubMed]
- Maitre NL, Slaughter JC, Aschner JL. Early prediction of cerebral palsy after neonatal intensive care using motor development trajectories in infancy. Early Hum Dev 2013;89:781-6. [Crossref] [PubMed]
- Ritterband-Rosenbaum A, Herskind A, Li X, et al. A critical period of corticomuscular and EMG-EMG coherence detection in healthy infants aged 9-25 weeks. J Physiol 2017;595:2699-713. [Crossref] [PubMed]
- Skiöld B, Eriksson C, Åden U, et al. General movements and magnetic resonance imaging in the prediction of neuromotor outcome in children born extremely preterm. Early Hum Dev 2013;89:467-72. [Crossref] [PubMed]
- Bouwstra H, Dijk-Stigter GR, Grooten HM, et al. Predictive value of definitely abnormal general movements in the general population. Dev Med Child Neurol 2010;52:456-61. [Crossref] [PubMed]
- Herskind A, Greisen G, Nielsen J. Early identification and intervention in cerebral palsy. Dev Med Child Neurol 2015;57:29-36. [Crossref] [PubMed]
- Haataja L, Mercuri E, Regev R, et al. Optimality score for the neurologic examination of the infant at 12 and 18 months of age. J Pediatr 1999;135:153-61. [Crossref] [PubMed]
- Romeo DM, Cioni M, Palermo F, et al. Neurological assessment in infants discharged from a neonatal intensive care unit. Eur J Paediatr Neurol 2013;17:192-8. [Crossref] [PubMed]
- Romeo DM, Cioni M, Scoto M, et al. Prognostic value of a scorable neurological examination from 3 to 12 months post-term age in very preterm infants: a longitudinal study. Early Hum Dev 2009;85:405-8. [Crossref] [PubMed]
- Romeo DM, Guzzetta A, Scoto M, et al. Early neurologic assessment in preterm-infants: integration of traditional neurologic examination and observation of general movements. Eur J Paediatr Neurol 2008;12:183-9. [Crossref] [PubMed]
- Haataja L, Mercuri E, Guzzetta A, et al. Neurologic examination in infants with hypoxic-ischemic encephalopathy at age 9 to 14 months: use of optimality scores and correlation with magnetic resonance imaging findings. J Pediatr 2001;138:332-7. [Crossref] [PubMed]
- Piper M, Darrah J. Motor Assessment of the Developing Infant. Philadelphia: WB Saunders, 1994.
- de Vries LS, van Haastert IC, Benders MJ, et al. Myth: cerebral palsy cannot be predicted by neonatal brain imaging. Semin Fetal Neonatal Med 2011;16:279-87. [Crossref] [PubMed]
- De Vries LS, Van Haastert IL, Rademaker KJ, et al. Ultrasound abnormalities preceding cerebral palsy in high-risk preterm infants. J Pediatr 2004;144:815-20. [Crossref] [PubMed]
- Reid SM, Dagia CD, Ditchfield MR, et al. Population-based studies of brain imaging patterns in cerebral palsy. Dev Med Child Neurol 2014;56:222-32. [Crossref] [PubMed]
- Krägeloh-Mann I, Horber V. The role of magnetic resonance imaging in elucidating the pathogenesis of cerebral palsy: a systematic review. Dev Med Child Neurol 2007;49:144-51. [Crossref] [PubMed]
- Mercuri E, Rutherford M, Cowan F. Early prognostic indicators of outcome in infants with neonatal cerebral infarction: a clinical, electroencephalogram, and magnetic resonance imaging study. Pediatrics 1999;103:39-46. [Crossref] [PubMed]
- Mercuri E, Barnett A, Rutherford M, et al. Neonatal cerebral infarction and neuromotor outcome at school age. Pediatrics 2004;113:95-100. [Crossref] [PubMed]
- Mayston M. Intervention, planning, implementation, and evaluation. In: Dan B, Mayston M, Paneth N, et al. editors. Cerebral Palsy: Science and Clinical Practice. London: Mac Keith Press, 2014:329-60.
- Dirks T, Blauw-Hospers CH, Hulshof LJ, et al. Differences between the family-centered "COPCA" program and traditional infant physical therapy based on neurodevelopmental treatment principles. Phys Ther 2011;91:1303-22. [Crossref] [PubMed]
- Dirks T, Hadders-Algra M. The role of the family in intervention of infants at high risk of cerebral palsy: a systematic analysis. Dev Med Child Neurol 2011;53:62-7. [Crossref] [PubMed]
- Morgan C, Novak I, Badawi N. Enriched environments and motor outcomes in cerebral palsy: systematic review and meta-analysis. Pediatrics 2013;132:e735-46. [Crossref] [PubMed]

陈一菁。南方医科大学珠江医院小儿神经康复科。2008年从南方医科大学临床医学本科毕业,进入南方医科大学珠江医院参加“3+2”模式的专科临床医师规范化培训并留院工作,2014年考入南方医科大学人体解剖与组织胚胎学研究生,2017年获得硕士学位,随后在南方医科大学珠江医院儿科中心工作至今。2021年完成INPP Post Graduate Course in INPP Theory, Diagnosis and Remediation of Neuromotor Immaturity using the INPP Method,2021,UK的一年制全球认证课程并获得资格证。(更新时间:2021/7/14)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Haataja L. Early diagnosis of cerebral palsy . Pediatr Med 2020;3:9.

